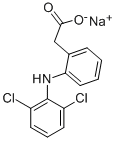
디클로페낙 나트륨 분말
제품 이름 : Diclofenac 나트륨 분말
설명
무엇인가요 디클로페낙 나트륨 분말?
디클로페낙 나트륨 분말은 진통, 항 기성적 및 차분한 작용을 가진 벤젠 산성 부식 유도체 및 비 스테로이드 완화 약물 (NSAID)의 디클로페낙 나트륨 염 유형입니다. 디클로페낙 나트륨 분말 Cyclooxygenase (COX)의 비 부분적 가역 및 심각한 억제제이므로, 프로스타글란딘 선구자로의 아라키 닉 부식성의 변형을 방해합니다. 이것은 고통, 악화 및 열과 관련된 프로스타글란딘의 배열을 방해한다.
기본 소개 디클로페낙 나트륨 분말
| 상품명: | 디클로페낙 나트륨 |
| 동의어 : | N- (2,6- 디클로로 페닐)-아미노 페닐 아세트산 나트륨 염; 나트륨 (O- ((2,6- 디클로로 페닐) 아미노) 페닐) 아세테이트; 나트륨 (O- (2,6- 디클로로 아닐 리노) 페닐) 아세테이트; 나트륨 디 클로 페낙; Tsudohmin; Akos B020028; 2- (2,6- 디클로로 아닐 리노) 페닐 아세트산 나트륨 염; 2- [(2,6- 디클로로 페닐) 아미노]-벤젠 반응산산 모노 소듐 염 |
| CAS : | 15307-79-6 |
| MF : | C14H10CL2NNAO2 |
| MW : | 318.13 |
| Einecs : | 239-346-4 |
| 제품 카테고리: | 다른 API; 휘장; 유기물; 아민; 방향족; 헤테로 사이클; 활성 제약 성분; 중간체 및 미세 화학 물질; 의약품; 스테로이드; 아피스; 지질 신호 전달 |
| mol 파일 : | 15307-79-6.mol |
|
|
|
나트륨 디 클로 페낙 화학적 특성 |
| 녹는 점 | 288-290 ° C |
| 밀도 | 0.781 g/cm3 |
| 스토리지 온도. | -20 ° C 냉동고 |
| 용해도 | H2O : 50 mg/ml |
| PKA | 4 (25 ℃에서) |
| 형태 | 흰색 고체 |
| 수용성 | 물에 50mg/ml로 가용성. |
| 머크 | 14,3081 |
| 안정: | 안정적인. |
Tsudohmin 안전 정보 |
| 위험 코드 | t, xi |
| Ridadr | UN 2811 6.1/pg 3 |
| WGK 독일 | 3 |
| RTECS | AG6330000 |
| 위험도 | 6.1 (b) |
| 포장 그룹 | III |
| HS 코드 | 29224999 |
| 독성 | 마우스에서 LD50, 쥐 (mg/kg) : ~ 390, 150 경구 (Krupp) |
디클로페낙 나트륨 분말 이점
Diclofenac 나트륨 분말 피부 젤은 피부를 통한 치료로 이익을 얻을 수있는 관절의 골관절염 고통 완화를 돕기 위해 사용됩니다. 이 관절은 손과 무릎을위한 관절을 기억합니다.
Diclofenac 유효 겔은 마찬가지로 액티 인 성 각화증 (AK)을 치료하는 데 사용됩니다. 이 상태는 더 노련한 어른의 피부에 불쾌한 층상 반점을 유발합니다.
Diclofenac은 비 스테로이드 완화 약물 (NSAID)입니다.
약물은 신체의 특정 화합물을 방해하여 작동합니다. 촉매가 방해받는 시점에서, 당신의 몸은 그것이 얼마나 많은 도발적인 합성 물질을 만드는지 감소합니다. 이것은 자극과 고통을 줄이는 데 도움이됩니다.
디클로페낙 나트륨 분말은 브랜드의 유명 약물 및 비 독립적 인 약물로 접근 할 수 있습니다. 브랜드 이름 : Solaraze, Voltaren.
Diclofenac 나트륨 분말은 마찬가지로 경구 정제 및 케이스, 시선, 구강 배열 용 분말 다발, 경피 고정 및 효과적인 배열을 포함한 다른 구조로 제공됩니다.
디클로페낙 나트륨 분말은 특정 관절에서 골관절염 고문을 치료하는 데 사용됩니다. 마찬가지로 그것은 액티 닉 각막증 (AK)을 치료하는 데 사용됩니다.
디클로페낙 나트륨 운송 및 패키지
Diclofenac 나트륨을 찾고 있습니까?
다음과 같이 연락하십시오. info@maxmedchem.com